
Lo sappiamo tutti: l’acqua assume la forma del recipiente che la contiene. Questo è poi il titolo – e il senso – di un celebre romanzo di Andrea Camilleri col noto protagonista Montalbano. Ma andando in fondo alla struttura intima dell’acqua, si scopre un’altra forma interessante, che dà origine alle sue straordinarie proprietà. È la sua struttura molecolare. Solo grazie a quella struttura possiamo assistere a fenomeni come quelli che, combinati insieme, portano l’acqua ad assumere anche la forma di una sequoia alta oltre cento metri, in barba alla forza di gravità. O a vedere un cubetto di ghiaccio galleggiare sull’acqua liquida, poter cuocere in modo ottimale i nostri spaghetti, zuccherare il caffè, e tante altre manifestazioni semplici per noi, ma che sono da considerare prodigiose per la maggior parte delle sostanze. Provate per esempio a far andare una macchina a vapore con un liquido diverso dall’acqua. Per capire almeno alcune di queste specialità occorre vedere un po’ da vicino cosa è l’acqua.
Chimica e fisica
La chimica delle molecole risponde abbastanza naturalmente alle leggi dell’elettricità. Cariche opposte si attraggono, cariche uguali si respingono. Inoltre vi sono delle altre regole che riguardano la “popolazione” elettronica di ciascun atomo. Senza farla troppo lunga, diremo qui che gli elettroni si dispongono su gusci che prendono il nome di orbitali, e rispondono a particolari leggi di occupazione. Il primo orbitale, il più “basso”, è saturo se contiene due elettroni. Il secondo invece lo diventa quando ne contiene otto. Si tratta delle condizioni di massima stabilità, minima energia, equivalenti a quelle dei cosiddetti gas nobili. Per esempio l’elio (He), il più leggero di questi gas, ha due protoni e due elettroni che completano il guscio interno. Questo gli conferisce una grande stabilità e una scarsissima propensione a combinarsi con altri elementi. Sta bene così. Invece l’idrogeno, elemento che lo precede nella tavola periodica, ha un solo protone e un solo elettrone, il che lo rende “affamato” di completezza: tende a mettere in condivisione il suo elettrone in modo da averne in cambio un altro per raggiungere la stabilità dell’elio. Un altro elemento affamato di completezza è l’ossigeno, che possiede sei elettroni nel secondo guscio, e ne “vorrebbe” otto per raggiungere la stabilità del neon, il secondo dei gas nobili. Questi elementi incompleti possono arrangiarsi da soli, formando molecole stabili. Per esempio l’idrogeno gassoso si trova sempre sotto forma di coppia di due atomi (H2), che lo rende stabile. Lo stesso capita per l’ossigeno (O2). Ecco perché la maggior parte degli elementi si trovano in natura in stato molecolare e non atomico. Il tipo di legame che li tiene insieme si chiama covalente e in genere dà luogo a molecole non polari, nel senso che presentano una distribuzione di cariche uniforme. Le molecole polari invece sono quelle che possiedono una distribuzione di cariche non simmetrica, per cui una certa parte della molecola risulta positiva, un’altra negativa. E adesso veniamo all’acqua.
Vi siete mai chiesti perché a temperatura ambiente due gas (idrogeno e ossigeno) combinati insieme generano un liquido?
La formula dell’acqua è H2O, ossia ogni molecola è fatta da due atomi di idrogeno “legati” con un atomo di ossigeno. Questo soddisfa per entrambi gli atomi l’esigenza di completezza dei gusci elettronici. Infatti l’ossigeno, condividendo un elettrone del suo guscio esterno con ciascun atomo di idrogeno ne guadagna due, e passa a otto. Lo stesso capita per l’idrogeno, che utilizza il legame covalente per completare il suo guscio. Come possiamo immaginare fisicamente questa molecola? H-O-H sembra una forma ragionevole, dato che i due nuclei di idrogeno, tendendo a respingersi, non potrebbero stare entrambi dalla stessa parte rispetto all’ossigeno. Potrebbe quindi sembrare logico immaginarla come una molecola lineare, come un manubrio da ginnastica con l’ossigeno in mezzo. Invece così non è, a causa di una dissimmetria dovuta agli altri elettroni del guscio esterno dell’ossigeno. Questi sono quattro, o meglio due “doppietti” e tendono a respingersi tra loro, ma anche ad attrarre i nuclei di idrogeno che si trovano nelle vicinanze. Il che dà luogo a una molecola che ha circa questo aspetto:
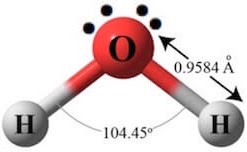
Dove sono evidenziati i due doppietti elettronici che ne formano la geometria. In realtà, la molecola andrebbe immaginata nelle tre dimensioni, e allora somiglierebbe a un tetraedro col centro occupato dall’atomo di ossigeno e con ciascuno dei vertici occupato dai due nuclei di idrogeno e dai due doppietti elettronici restati liberi. Una molecola con una polarità piuttosto accentuata. Tutto questo è spiegato, con numerosi dettagli e immagini molto ben realizzate, a questo link.
Molecole di questa forma, se si trovano vicine tendono a stabilire dei legami tra i nuclei di idrogeno (positivi) e gli elettroni che stanno dalla parte opposta (negativi). Questo tipo di legame, molto più debole del legame chimico che forma le molecole, si chiama legame a idrogeno, ed è la base del comportamento speciale dell’acqua. Infatti, ogni molecola tende a legarsi con altre quattro intorno e così via fino a creare una vera e propria rete di molecole tutte legate tra loro, debolmente ma non troppo. Da questo legame dipendono essenzialmente tutte le caratteristiche, le più note delle quali sono la capillarità, la tensione superficiale, le proprietà solventi, oltre alle varie proprietà fisiche, ossia il punto di fusione, quello di congelamento eccetera. Questo legame spiega anche perché l’acqua è liquida a temperatura ambiente, mentre i gas da cui origina diventano liquidi a temperature estremamente basse (-253°C per l’idrogeno, −183°C per l’ossigeno).
Vediamo altre caratteristiche, in ordine sparso.
La temperatura di ebollizione (e quella di fusione) dell’acqua è molto più alta rispetto a quella di altre molecole simili, che si trovano infatti lo stato gassoso. Grazie a queste caratteristiche troviamo sulla terra tanta acqua liquida, che però convive anche con lo stato gassoso (vapore d’acqua) e con quello solido (ghiaccio).
La capillarità è un fenomeno dovuto all’effetto combinato di forze di adesione e coesione grazie al quale l’acqua può risalire le pareti di uno stretto recipiente, violando il principio dei vasi comunicanti. Grazie alla capillarità un fazzoletto di carta e una spugna si inzuppano con facilità. Conosciamo tutti, purtroppo, l’umidità di risalita che guasta le strutture murarie nei piani bassi delle case. Anch’essa è dovuta alla capillarità. Con l’adesione le molecole dell’acqua stabiliscono un contatto con le molecole della parete del recipiente, grazie al legame idrogeno queste molecole riescono ad “arrampicarsi” lungo le pareti, mentre la forte coesione consente alla massa d’acqua di rimanere unita salendo. Questo fenomeno è tanto più evidente quanto più piccolo è il capillare.
Un altro comportamento anomalo dell’acqua è dato dall’aumento del volume di congelamento della massa liquida. A livello domestico sono ben note le conseguenze di questo fenomeno. Quando la temperatura va sottozero le tubazioni piene d’acqua si rompono, così come una bottiglia piena messa nel freezer. Nell’acqua liquida agiscono due forze opposte, i legami a idrogeno da una parte tendono ad organizzare il reticolo di tetraedri mentre il movimento caotico delle molecole ne impedisce la perfetta formazione. Quando l’acqua congela i tetraedri sono obbligati a formarsi e la struttura complessiva assume la configurazione più aperta e meno densa. Questo è il motivo per cui, stranamente, il ghiaccio galleggia. Parliamo nuovamente di questa preziosissima caratteristica in fondo a questo articolo.
Il potere solvente di una sostanza è la capacità che la stessa ha di scioglierne un’altra, per formare una soluzione. L’acqua è un ottimo solvente, avendo la capacità di spezzare i legami che tengono unite molte sostanze. Pensiamo al cloruro di sodio, cioè il sale da cucina, che si scioglie rapidamente in acqua perché le molecole polari dell’acqua attraggono gli ioni di carica opposta sino a spezzare il legame ionico del cristallo. Un analogo fenomeno avviene nel processo di mineralizzazione, cioè quando l’acqua, passando attraverso le rocce, ne discioglie una parte arricchendosi di sali minerali.
La tensione superficiale è la densità superficiale di energia di legame sull’interfaccia tra un corpo continuo e un materiale di un’altra natura, un solido, un liquido o un gas. L’acqua ha un’elevata tensione superficiale perché tra le molecole è presente una forte coesione (dovuta ai legami idrogeno), che tende a tenerle unite.
Grazie a questo fenomeno molti insetti riescono a camminare sull’acqua, visto che la loro massa non è sufficiente a rompere i legami tra le molecole d’acqua presenti superficie, e non basta il principio di Archimede per spiegare il galleggiamento di una graffetta metallica o di una piccola monetina.
Ed è sempre grazie alla coesione, che genera una forte tensione superficiale, se le goccioline d’acqua assumono una forma sferica e se un bicchiere si può riempire per qualche millimetro oltre il bordo, senza traboccare.
Acqua che risale negli alberi
Ma adesso veniamo alla domanda delle domande: dato tutto questo, come possiamo spiegare che l’acqua possa risalire fino alla cima degli alberi più alti? Nelle piante non sono presenti strutture che spingono l’acqua fino alle foglie dei rami più alti. In altre parole, le piante non hanno un “cuore” come gli animali, ma sono costituite essenzialmente da fasci di minuscoli tubi verticali (xilema) che percorrono tutta la struttura dalle radici fino alle estremità delle foglie più lontane. Questi tubini sono costantemente pieni d’acqua, ed è per questo che possiamo dire che, nel caso di un albero, l’acqua che contiene ha esattamente la sua forma. Vediamo come avviene.
- osmosi: l’acqua del terreno passa per osmosi all’interno dei peli radicali attraverso la membrana costituita dalle cellule epidermiche. I peli radicali, assumendo dal terreno soluzioni di ioni inorganici e di piccole molecole di sali minerali, permettono l’instaurarsi di un gradiente di concentrazione tra l’esterno (soluzioni poco concentrate nel terreno) e l’interno della pianta (soluzioni molto concentrate nelle cellule). Si genera così la cosiddetta “pressione radicale” che può essere sufficiente a spingere l’acqua fino ad altezze maggiori di quanto permetta la capillarità, ma che non è certo in grado di farle raggiungere le sommità di grossi alberi o dei lunghi steli delle piante rampicanti. Se tagliamo il tronco di una giovane pianta fresca, vediamo che dalla superficie superiore continua per un po’ a sgorgare dell’acqua, che in realtà è linfa. Questo è il segno della presenza di una pressione radicale.
- capillarità: se si considerano i minuscoli diametri dei vasi xilematici in cui scorrono acqua e sali minerali, è chiaro che la risalita capillare, unitamente alla pressione radicale, può svolgere un ruolo importante potenziando l’ascesa della linfa. In particolare, le caratteristiche polari delle molecole di cellulosa, costituente principale delle pareti cellulari delle piante, rendono questa sostanza altamente idrofilica e in grado, quindi, di instaurare forze di adesione particolarmente intense con le molecole d’acqua. Tuttavia, anche prendendo in considerazione la capillarità e la pressione radicale non si riesce a spiegare la risalita delle molecole d’acqua fino a quote considerevoli. Però, si può trovare un nuovo elemento di aiuto alla comprensione del fenomeno in questione se si considera che più del 90 per cento dell’acqua assorbita da una pianta viene persa per traspirazione, eliminata attraverso le foglie. Ora, in questo processo che sembrerebbe uno spreco di energia e di acqua, vi è un diretto collegamento con la risalita della linfa grezza, in quanto, perdendo acqua per traspirazione dalle foglie, si genera nei tubicini rigidi dello xilema la necessaria depressione che appunto aspira linfa grezza verso l’alto.
- pressione negativa: la depressione esercitata per evaporazione ovviamente dipende dalla natura e dimensione della chioma, dall’intensità del calore solare e della traspirazione; eliminando gli attriti, si calcola che rimane una depressione di circa 15 atmosfere, tale da consentire la risalita della linfa grezza fino agli oltre 100 metri delle sequoie.
Dal punto dio vista energetico, l’energia necessaria per la risalita della linfa è fornita dal sole, che scaldando le foglie porta l’acqua dallo stato di liquido a quello di vapore permettendo così la traspirazione.
Dunque, in definitiva un “motore” lo abbiamo trovato: si tratta di una “pompa aspirante” alimentata dall’energia solare che, favorendo l’evaporazione dell’acqua presente nelle foglie, crea la depressione che richiama nuova linfa dallo xilema. Una macchina portentosa, che in aggiunta a quella che produce le sostanze nutritive mediante la fotosintesi clorofilliana, rende le piante i meravigliosi organismi che conosciamo.
Pressione radicale, capillarità e traspirazione cooperano sinergicamente alla salita dell’acqua fino alle foglie: le prime due spingono dal basso, la traspirazione tira dall’alto. L’acqua fa il resto, trasformandosi in filamenti sottilissimi (quanto un capello e anche meno) che si lasciano spingere e tirare ma non si spezzano, grazie al legame a idrogeno. Tra l’altro l’acqua è anche poco comprimibile.
Dalle radici che forniscono costantemente nuova soluzione salina fino ai germogli apicali, la pianta è quindi percorsa da un flusso continuo di acqua che, attraverso la traspirazione, si disperde nell’ambiente. Una percentuale di tutta quest’acqua, trasformata dalle foglie in “linfa elaborata”, viene poi risospinta attraverso un percorso parallelo, fino al basso, fornendo nutrimento a tutto l’apparato vegetale. Questo fenomeno ha delle dimensioni sorprendenti ma che permettono di dare ragione della risalita della linfa: un modesto albero di betulla traspira più di trecento litri d’acqua al giorno, molta più di quella che evaporerebbe dal suolo nudo; così anche una semplice pianta di grano, che pesa meno di mezzo chilo al momento del raccolto, ha assunto, trasportato e liberato nell’atmosfera quasi due quintali di acqua durante la sua vita.
L’acqua evapora continuamente dalla superficie delle foglie esposte all’aria attraverso particolari aperture: gli stomi. Questo fenomeno, chiamato traspirazione, viene regolato dalla maggiore o minore apertura degli stomi stessi: se sono aperti l’acqua lascia la foglia in forma di vapore; se sono chiusi, l’acqua rimane trattenuta al suo interno e si evitano perdite eccessive di liquido. A causa dell’elevatissima coesione interna, l’evaporazione delle molecole d’acqua dalla foglia realizza, con la traspirazione, una situazione di squilibro e di “tensione” che si traduce in una forza diretta verso l’alto che aspira l’acqua nella parte alta del sistema vascolare, vincendo la forza di gravità. Così il flusso d’acqua, trascinato dalle molecole che stanno evaporando, scorre senza frammentarsi dalla base dell’albero alla chioma.
L’acqua resiste a questa tensione come un elastico teso che si deforma ma non si rompe a causa della fitta rete di legami idrogeno che la mantiene coesa. Il mantenimento di una colonna continua di liquido è fondamentale per la sopravvivenza della pianta: un’interruzione dovuta, per esempio, alla presenza di bolle che ostruissero il passaggio, provocherebbe la separazione in due spezzoni della colonna stessa con la parte inferiore che non potrebbe più essere richiamata verso la chioma. La struttura altamente interconnessa dei vasi xilematici garantisce la possibilità di trovare percorsi alternativi in caso di interruzione, il piccolo diametro dei tubicini che li compongono ed una sostanziale impermeabilità delle pareti dei tubicini che non lascia disperdere l’acqua nei tessuti vegetali, impediscono perdite di acqua e di pressione lungo il percorso, costituendo le raffinate difese che le piante hanno sviluppato evolutivamente per impedire la formazione di tali bolle ed i loro effetti.
Provate a pensare a tutto ciò, quando attraversate un bosco e osservate dal basso le chiome di alberi altissimi, e provate a immaginarne l’interno, semplice, resistente, a prova di anni e anche di secoli, in certi casi di millenni. Niente che si possa guastare per usura, ma solo per l’attacco esterno di parassiti, sostanze chimiche o l’azione sconsiderata dell’uomo, che arriva a dar fuoco ad intere foreste o ad abbatterle per far posto alla “civiltà”.
Per finire vi offriamo un breve capitolo tratto dal libro Doppio Sei di Leonardo Mureddu, un libro che parla delle molte fortune che hanno permesso lo sviluppo della vita sulla Terra, tra cui naturalmente l’acqua. Il capitolo s’intitola Quattro gradi e coinvolge anche le anatre del Central Park di New York. Buona lettura!
Zer037, febbraio 2024
Per motivi di spam selvaggio i commenti vengono disabilitati due settimane dopo la pubblicazione. Scrivici all’indirizzo zero37@zero37.org